今日《自然》揭示长寿关键,延缓衰老在于休息少动。
药明康德报道:老话说,生命在于运动。可是今天顶尖学术期刊《自然》在线发表的一项新研究却告诉我们,长寿在于REST(休息)……
来自哈佛大学医学院的Bruce Yankner教授及其合作者,基于在模式生物和人类身上所做的各种研究,揭示了神经活动与衰老之间的意外联系。他们发现,大脑整体神经兴奋性对动物寿命有决定性的影响,而一种名为REST的蛋白是其中关键的调节因素。
《自然》对文章做出的评述说,这一发现“或许有助于研究人员寻找延缓人类衰老的新方法”。
 ▲Bruce Yankner教授的研究组致力于理解衰老、尤其是大脑老化的分子基础(图片来源:哈佛医学院官网)
▲Bruce Yankner教授的研究组致力于理解衰老、尤其是大脑老化的分子基础(图片来源:哈佛医学院官网)
先来认识一下REST蛋白。它的全称是抑制元素-1-沉默转录因子,顾名思义,这种蛋白可以抑制某些基因的表达。在神经细胞中,受REST蛋白调控的基因包括一些与神经元兴奋性、突触(神经元之间的连接结构)功能有关的基因。所以,REST活性增加时,可以起到防止神经网络过度兴奋的作用。
Yankner教授过去的研究就注意到这一转录因子可能在调节大脑衰老方面发挥作用。在健康老年人脑中,REST蛋白会被诱导,变得活跃起来;而在诸如阿尔茨海默病等神经退化的老年人脑中,神经细胞丧失REST蛋白。
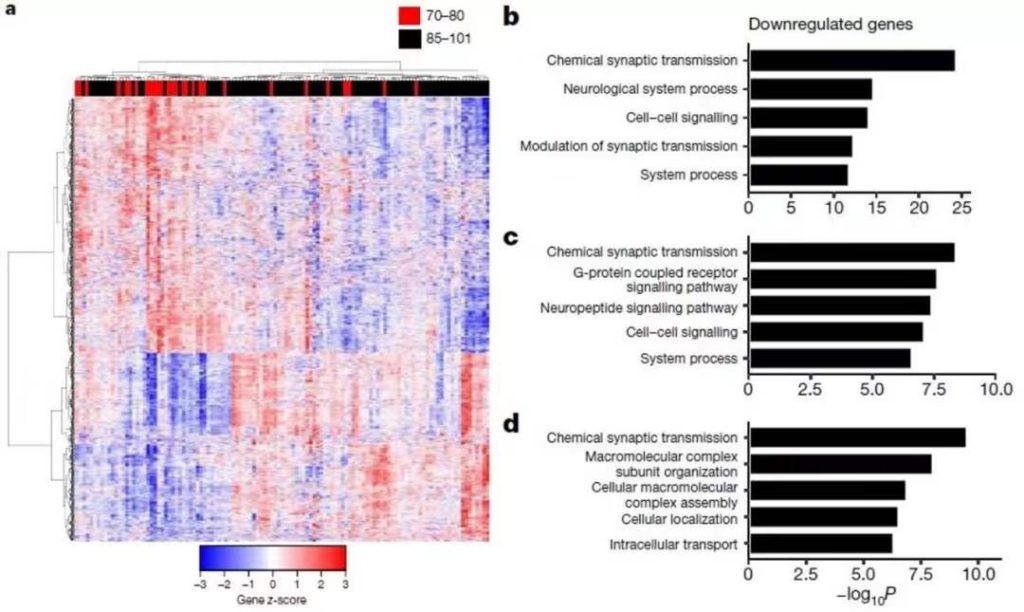 ▲REST在正常老化大脑的神经元中被诱导表达(图片来源:参考资料[4])
▲REST在正常老化大脑的神经元中被诱导表达(图片来源:参考资料[4])
此次研究中,科学家们在分析老人的大脑样本时,按照去世年龄分了组,比较各组之间基因表达的差别。这些老人生前都没有认知缺陷,但有意思的是,85岁以上的长寿组中,那些与神经兴奋和突触功能相关的基因被下调,表达量相对较低。
另一个现象是,相比只有七八十岁的老人,百岁老人的大脑前额叶皮层中,细胞核内的REST蛋白水平更高。这些结果提示,抑制神经活动的兴奋性或许与长寿有联系。
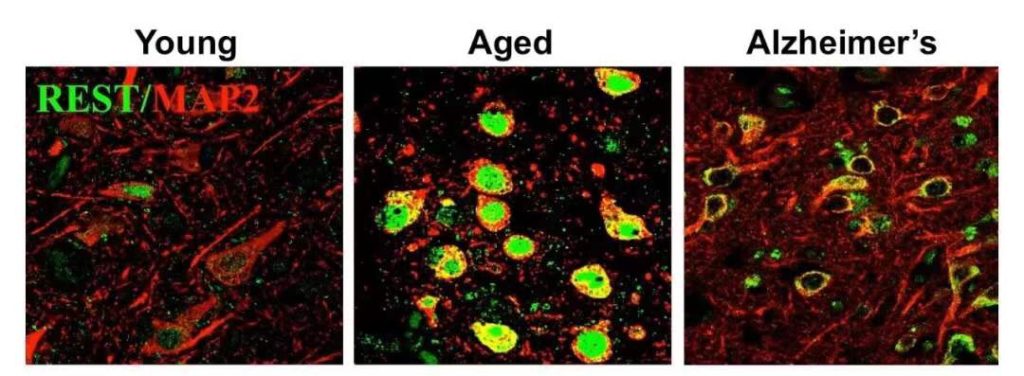 ▲认知正常的长寿老人,大脑皮层中与神经兴奋性和突触功能有关的基因表达下调(图片来源:参考资料[1])
▲认知正常的长寿老人,大脑皮层中与神经兴奋性和突触功能有关的基因表达下调(图片来源:参考资料[1])
那么问题来了,这种联系仅仅是伴随着变老过程发生的呢,还是存在因果关系?换句话说,可以证明神经兴奋水平影响寿命吗?
为了做出直接回答,科学家们转而在一种实验动物上开展实验、寻找证据。线虫(Caenorhabditis elegans)由于神经环路简单清晰、生命周期短等优点,是目前研究衰老常用的一种模式生物。
▲老中青线虫,衰老的线虫(最右)运动能力降低(视频来源: J. Durieux, Dillin Lab)
研究人员用药物和遗传操纵手段干预线虫的神经活动,无论是降低它们整体的神经兴奋性还是减少突触的信号传递,线虫的寿命都得到了延长!相反,增强神经活动,会缩短线虫的寿命。
线虫的基因组中,也有基因编码对应于人类REST的蛋白,SPR-3和SPR-4。当研究者人为增加或减少这组转录因子的水平,可以调节线虫的神经兴奋/抑制模式,同样还会影响线虫的寿命。
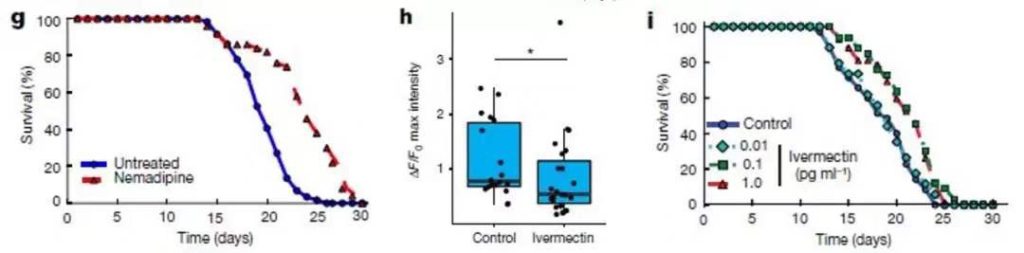 ▲降低神经兴奋性,线虫的寿命延长(图片来源:参考资料[1])
▲降低神经兴奋性,线虫的寿命延长(图片来源:参考资料[1])
对受调控的基因网络做进一步分析时,这项研究揭示出了一个有趣的机制。科学家发现,神经活动对寿命的影响和一条重要的代谢信号通路有关:胰岛素/胰岛素生长因子1(IGF1)信号。这是已知的第一条影响寿命的信号通路。
低胰岛素/IGF1信号可以显著延长寿命,正是在线虫身上首次得到阐述,此后又在许多其他物种上获得证实。而Yankner教授的这项研究发现,神经元表达的SPR-3/4是其中的关键。如果缺少这组蛋白,动物恢复较高的神经兴奋性,那么低胰岛素/IGF1信号带来的长寿好处就会大打折扣。
类似的结果在哺乳动物小鼠身上也得到了验证:神经元内的REST蛋白与神经活动会调节代谢信号通路中的关键分子。
 ▲在线虫和哺乳动物中,神经兴奋性调节寿命的机制示意图(图片来源:参考资料[2])
▲在线虫和哺乳动物中,神经兴奋性调节寿命的机制示意图(图片来源:参考资料[2])
基于这些发现,研究者提出了延缓衰老的新思路,“设法提高REST水平、减少兴奋性神经元活动,或许是延缓人类衰老的一种方法。”作者在论文最后说。
参考资料:
[1] Joseph Zullo et al., (2019) Regulation of lifespan by neural excitation and REST. Nature. DOI: 10.1038/s41586-019-1647-8
[2] Nektario Tavernarakis (2019) Neural excitation moderates lifespan. Nature. DOI:
[3] INTRODUCTION TO AGING IN C. ELEGANS. Retrieved Oct. 16, 2019, from https://www.wormatlas.org/aging/introduction/AIntroframeset.html
[4] Tao Lu et al., (2014) REST and stress resistance in ageing and Alzheimer’s disease. Nature. DOI: 10.1038/nature13163
