疟疾仍然是世界上最致命的疾病之一。每年,疟疾感染导致数十万人死亡,其中大多数死亡发生在五岁以下的儿童身上。美国疾病控制与预防中心最近宣布,在美国发现了五例蚊子传播的疟疾病例,这是20年来首次报告在该国传播。
幸运的是,科学家们正在开发安全的技术,通过对传播疟疾寄生虫的蚊子进行基因编辑来阻止疟疾的传播。由Omar Akbari教授的实验室领导的加州大学圣地亚哥分校研究人员开发了一种新的方法来从基因上抑制冈比亚按蚊的种群。冈比亚按蚊主要在非洲传播疟疾,并导致受影响地区的经济贫困。新系统针对冈比亚冈比亚种群中的雌性并杀死它们,因为它们会叮咬并传播疾病。
加大圣地亚哥分校(UCSD)的研究人员开发新的基因技术来阻止疟疾传播的蚊子。
开发论文已于7月5日发表在《科学进展》期刊,第一作者Andrea Smidler是加州大学圣地亚哥分校生物科学学院的博士后学者,他与前硕士生、第一作者之一James Pai 和 Reema Apte 一起创建了一个名为 “Ifegenia” 的系统,这是“通过基因编码核酸酶中断等位基因来消除遗传性女性(inherited female elimination by genetically encoded nucleases to interrupt alleles.)” 的首字母缩写。该项技术利用CRISPR技术破坏一种名为无雌性(fle)的基因,该基因控制冈比亚蚊子的性发育。
加州大学伯克利分校和加州理工学院的科学家为这项研究做出了贡献。

图为Ifegenia技术研究第一作者Andrea Smidler(左)和共同第一作者Reema Apte。
Ifegenia通过在非洲蚊子体内对CRISPR的两个主要元素进行基因编码来发挥作用。其中包括一种Cas9核酸酶,一种进行切割的分子“剪刀”,以及一种通过Akbari实验室在这些蚊子身上开发的技术将系统引导到目标的引导RNA。他们对两个蚊子家族进行了基因改造,使其分别表达Cas9和fle靶向引导RNA。
“我们把它们杂交在一起,在后代中,它杀死了所有的雌性蚊子,” Smidler说,“这太不寻常了。” 与此同时,冈比亚雄性蚊子继承了伊芬尼亚,但基因编辑不会影响它们的繁殖。它们在繁殖方面仍然适合交配和传播Ifegenia。寄生虫的传播最终停止了,因为雌性被移除,种群达到了繁殖的死胡同。作者指出,新系统避开了其他系统(如基因驱动)面临的某些遗传抗性障碍和控制问题,因为Cas9和引导RNA成分保持分离,直到种群准备好被抑制。
细胞与发育生物学系教授Omar Akbari表示,“这项技术有可能成为世界一劳永逸地消灭疟疾所急需的安全、可控和可扩展的解决方案。”
作者在论文中指出:“我们表明,Ifegenia雄性仍然具有繁殖能力,并且可以加载fle突变和CRISPR机制,在后代中诱导fle突变,从而导致持续的种群抑制。”。“通过建模,我们证明了不咬人的伊芬尼亚雄性的迭代释放可以作为一种有效、可靠、可控和安全的种群抑制和消除系统。”
对抗疟疾传播的传统方法,如蚊帐和杀虫剂,越来越多地被证明在阻止疾病传播方面无效。杀虫剂仍在全球大量使用,主要是为了阻止疟疾,因为疟疾增加了非洲和亚洲地区的健康和生态风险。
Smidler在2019年加入加州大学圣地亚哥分校之前获得了哈佛大学的博士学位(公共卫生生物科学),她正在利用自己在基因技术开发方面的专业知识来解决疾病的传播及其带来的经济危害。她和同事开发出Ifegenia后,她对该技术作为一种抑制系统的有效性感到惊讶。
细胞与发育生物学系教授Akbari说:“这项技术有可能成为世界一劳永逸地消灭疟疾所急需的安全、可控和可扩展的解决方案。”。“现在,我们需要转变努力,寻求社会认可、监管使用授权和资金机会,以对这一系统进行最终测试,抑制野生疟疾传播蚊子种群。我们正处于在世界上产生重大影响的风口浪尖,在实现这一目标之前不会停止。”
研究人员指出,Ifegenia背后的技术可以适用于传播致命疾病的其他物种,如已知传播登革热 – dengue (break-bone fever) 、基孔肯雅病 (chikungunya)和黄热病( yellow fever viruses) 病毒的蚊子。
共同作者还包括Andrea Smidler、James Pai、Reema Apte、Hector Sanchez C.、Rodrigo Corder、Eileen Jeffrey Gutierrez、Neha Thakre、Igor Antoshechkin、John Marshall 和 Omar Akbari。
该技术项目研究的资金来自DARPA安全基因计划拨款、美国国立卫生研究院奖和比尔及梅琳达·盖茨基金会。
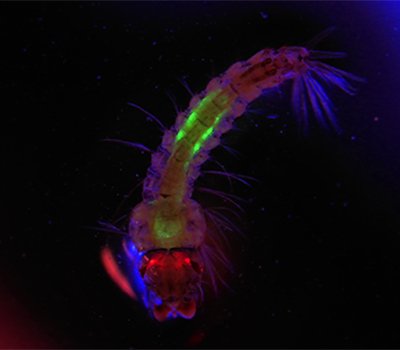
题图为在一个新的种群抑制系统中,冈比亚按蚊的幼虫被注射了基于CRISPR的基因编辑工具。
来源:加大圣地亚哥分校。
(美国华文网编发)