药明康德报道 :近日《Nature》深度综述,解密癌细胞的“逃脱绝技”,除基因突变之外另有方法!
请看药明康德团队对《Nature》该综述的编译整理:
历史上著名的魔术大师哈里·胡迪尼(Harry Houdini)最拿手的绝技就是“逃脱戏法”,他能够从任何手铐、绳索、保险柜等束缚中成功逃脱。而癌细胞似乎也是细胞中的“胡迪尼”,无论采用什么类型的疗法,总有一些癌细胞能够逃脱疗法的杀伤而卷土重来 。它们又有什么“绝技”能够屡屡逃脱抗癌疗法的追杀?近日,Nature Reviews Drug Discovery 上发表的一篇综述对癌细胞的“逃脱戏法”进行了盘点。今天药明康德内容团队将结合这篇综述与其它公开材料的内容,为读者介绍一下癌细胞的“逃脱绝技”和我们能够采取的应对策略 。
在癌症耐药性的研究中,历史上最受研发人员关注的是基因突变驱动的耐药性 。简单来说,抗癌疗法,尤其是靶向药物,通常通过抑制特定靶点的功能来导致癌细胞的死亡。而癌细胞可以通过产生基因突变,导致它们可以绕过靶点被抑制的影响 ,比如在靶点蛋白上的突变导致药物无法再跟靶点结合;或者激活信号通路下游的效应子,或者激活替代生存信号通路。这些基因突变可能原先就在很少的细胞中存在,也可能在接受药物治疗的过程中产生。带来的结果是携带突变的癌细胞对靶向疗法产生耐药性。
而近年来的研究表明,癌细胞在不产生基因突变的情况下,也能够对靶向疗法产生耐药性 。这种“逃脱方法”与癌细胞的可塑性(plasticity)相关 ,有些癌细胞通过在基因表达和表观遗传学方面的改变,转变成为更能够耐受抗癌疗法的形态。这种耐药性的产生方式近年来成为科学家们研究的重要方向。下面我们来看看这种耐药性产生的机制。
参考资料[2])
药物诱导可塑性(drug-induced plasticity)的机制
接受药物治疗后细胞可塑性的分子机制目前尚未完全阐明,不过癌细胞形态的转变过程很可能分为两步:第一步,癌细胞进入一个生长缓慢的药物耐受状态,然后这种细胞进一步重新编程,成为耐药性细胞 。
从对药物敏感的增殖状态转变为生长缓慢、对药物耐受的状态并不是癌细胞的“独门绝技”。事实上,这种细胞状态的改变最初在细菌中被发现 ,细菌在遇到抗生素挑战后可以呈现对药物产生耐受,但是生长缓慢的状态。然而在去掉抗生素之后,它们又会恢复到增殖状态,并且重新对抗生素敏感。这个现象表明耐药的可塑性并不是由基因变化介导的。
有趣的是,在体外试验表明,癌细胞也采用了类似的策略。这种对原本致命药物产生暂时耐受能力的癌细胞亚群称为“drug-tolerant persisters”(DTPs),它们最初在非小细胞肺癌(NSCLC)中被发现,而后在结肠癌、黑色素瘤和胶质母细胞瘤中也被发现。与细菌一样,当去掉抗癌药物之后,这些原本对药物耐受的细胞又会生成对药物敏感的细胞,意味着它们的耐药状态是暂时的 。
进一步的研究表明,细胞进入分裂缓慢的状态是对药物产生耐受的先决条件,而且这种耐药机制似乎独立于癌症类型和药物类型。 这一发现意味着靶向细胞转变为分裂缓慢状态的过程是一种有趣的抗癌策略 。例如,在基底细胞癌(BCC)中,如果迫使对药物产生耐受的缓慢分裂细胞加快增殖,会让它们重新对Hedgehog(Hh)信号通路抑制剂vismodegib敏感,导致细胞的死亡。
这些对药物产生耐受,分裂缓慢的细胞能够通过进一步的重新编程,获得对药物的永久抗性。这一重新编程的过程与表观遗传学和转录变化相关。此外,肿瘤的微环境和癌细胞的起源可能在抗性状态的产生中也起到重要作用。
细胞对药物耐受能力的可逆性表明,表观遗传学层面上的重新编程起到了非常重要的作用,近来的研究也表明,细胞表型的变化与组蛋白甲基化的显著改变相关 。例如,具有组蛋白甲基转移酶功能的EZH2蛋白在神经内分泌前列腺癌中高度表达。神经内分泌前列腺癌是一种严重的去势抵抗性前列腺癌。这些癌细胞转化成为不依靠雄激素受体介导的信号通路进行增殖的形态,因此对靶向雄激素信号通路的疗法产生耐药性。使用遗传学或者药理手段在转化为神经内分泌形态的前列腺癌细胞中抑制EZH2蛋白的活性,能够逆转这种细胞表型的转变,恢复它们对药物的敏感性 。
值得注意的是,EZH2的高度表达在肺癌小鼠模型中促进肺癌细胞分化为神经内分泌形态,这意味着EZH2可能在多种癌症类型中介导神经内分泌表型的分化。
除了EZH2以外,名为REST的表观遗传学因子也在神经内分泌前列腺癌和肺癌中介导癌细胞向神经内分泌表型的分化。
科学家们对癌细胞转录组的分析发现了与细胞可塑性相关的重要转录因子,其中SOX 基因家族中的多个成员在介导药物引发的细胞可塑性方面起到重要作用。其中,在动物试验中,SOX2 可以诱导前列腺癌和肺癌细胞分化为神经内分泌表型。而SOX10 能够诱导黑色素瘤和乳腺癌细胞分化为与神经脊(neural crest)细胞类似的状态,并且对药物产生抗性 。
近年来的研究还发现了与药物引发的细胞可塑性相关的多条信号通路。它们包括WNT-β-连环素信号通路, IL-6-STAT3信号通路,以及类维生素A X受体(retinoid X receptor, RXR)信号通路。
实体瘤不但包括癌细胞,还包括成纤维细胞、内皮细胞、肿瘤浸润免疫细胞等多种复杂成分。复杂的肿瘤微环境通过分泌因子和细胞外基质能够调控细胞的可塑性,从而介导药物抗性的产生。
癌症相关成纤维细胞(CAFs)在黑色素瘤中通过分泌肝细胞生长因子(HGF)等可溶性因子,以及与癌细胞的接触,促进疗法抗性产生。临床试验数据表明,血浆中HGF因子水平越高,患者对BRAF抑制剂vemurafenib的响应越差。
除了CAFs以外,巨噬细胞、炎症、和血管密度/分布都与药物抗性的产生相关。
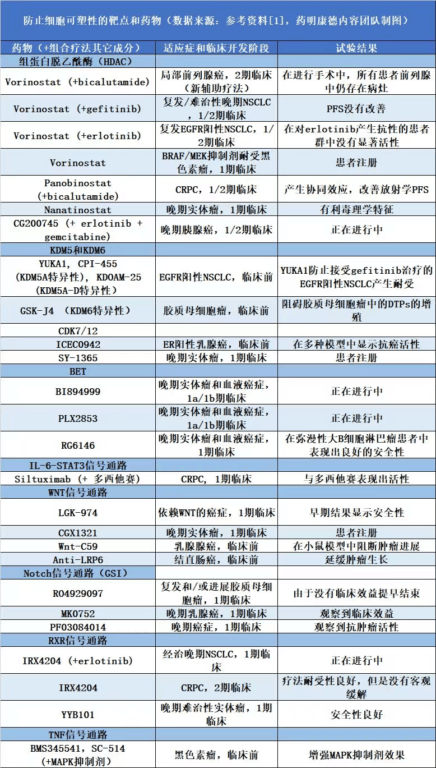
由于细胞可塑性在药物耐受和抗性的产生方面具有的重要作用,靶向促进细胞可塑性的机制有望带来更深入和持久的疗效。针对细胞可塑性的治疗策略可以分为三大类:通过抑制调控细胞可塑性的分子机制,防止可塑性的产生; 特异性靶向细胞转化之后的形态; 逆转细胞转化的过程 。下面我们来看看科学家们在这三个方面取得了哪些进展。
参考资料[1]) 因为对产生耐受的残余癌细胞进行持续治疗可能导致它们转变为永久耐药的形态,理论上使用间歇性治疗可能帮助抑制抗性的产生 。有趣的是,在使用vemurafenib治疗黑色素瘤细胞时,间歇性给药方式将细胞对药物敏感的时间延长了一倍。间歇性治疗方式在控制前列腺癌患者的肿瘤进展方面也表现出可喜的效果。
而应付细胞可塑性产生的另一个方法是靶向导致细胞表型变化的关键信号节点 。目前有多款在研疗法在临床前和早期临床试验中靶向在细胞形态转化中起到重要作用的表观遗传学因子、转录因子以及关键性信号通路,详细信息请看下面的表格。
细胞转化为对药物产生抗性的形态之后,虽然对已有疗法产生了抗性,但是可能暴露出新的弱点,靶向新的弱点可能带来新疗法。
例如,在NSCLC中,受体酪氨酸激酶AXL的表达与癌细胞的上皮间质转化(EMT)特征相关,这意味着AXL可能成为治疗NSCLC的新靶点。AXL抑制剂SGI-7079与EGFR抑制剂erlotinib联用,能够在小鼠模型中提高间质样NSCLC细胞对erlotinib的敏感性。黑色素瘤细胞在接受药物治疗后也会提高AXL的表达,在肿瘤移植模型中,使用靶向AXL的抗体偶联药物和MAPK抑制剂能够协同作用,抑制肿瘤的生长。
针对细胞转化后形态中新靶点的研究信息请参见下面的表格。
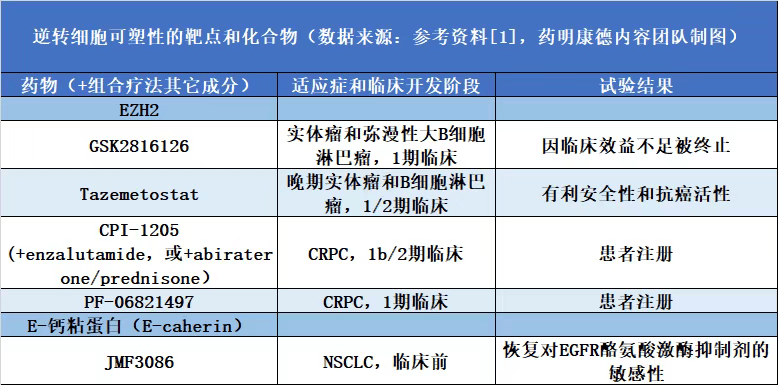
由于细胞可塑性主要受到表观遗传机制的调控,因此使用药物疗法逆转这一过程,理论上可以让这些细胞重新对药物变得敏感。
如前所述,EZH2的高度表达与前列腺癌在接受第二代雄激素疗法治疗后转化为神经内分泌前列腺癌相关。因此,多款EZH2抑制剂在多项临床试验中接受检验。然而,葛兰素史克(GSK)公司的EZH2抑制剂GSK2816126在1期临床试验中并没有表现出足够的临床活性。这意味着研究人员可能需要考虑其它表观遗传学调节因子,例如REST。
此外,使用靶向蛋白降解手段,可以靶向原先难于成药的转录因子蛋白(例如SOX蛋白),从而对逆转调控细胞可塑性的基因表达过程。在逆转EMT过程方面,靶向E-钙粘蛋白合成过程的JMF3086导致E-钙粘蛋白的重新表达,并且让NSCLC细胞系对EGFR酪氨酸激酶抑制剂重新产生敏感性。
虽然靶向疗法的问世给癌症治疗带来了长足的进步,但是癌细胞也发展出相应的“逃脱绝技”。除了已被深入研究的基因突变以外,近来的研究发现细胞可塑性是癌细胞逃脱疗法杀伤的重要原因。
靶向细胞可塑性有望提供一种改善已有疗法的疗效和持久性的独特渠道。虽然近年来的研究发现了介导细胞可塑性的一些分子机制,但是想要更好地了解和靶向这一过程,我们还需要克服多重挑战。其中包括发现更多预测性生物标志物,让我们能够依据细胞可塑性对患者进行细分。更精确地了解肿瘤细胞表型变化的动态进展,不同的患者在接受药物治疗后,残余的肿瘤细胞可能处于不同的耐药状态。由于肿瘤的异质性,残余的肿瘤细胞也可能采用不同的机制诱发可塑性的产生。因此,对残余肿瘤细胞的分析将是指导进一步治疗的关键。
我们期待随着科技的进步,科学家们能够克服这些挑战,设计出堵死癌细胞逃脱之路的方法,延长患者的缓解时间,甚至让治愈成为可能!
题图来源:Pixabay
参考资料:
[1] Boumahdi & Sauvage, (2019). The great escape: tumour cell plasticity in resistance to targeted therapy. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-019-0044-1
[2] Easwaran et al., (2014). Cancer Epigenetics: Tumor Heterogeneity, Plasticity of Stem-like States, and Drug Resistance. Molecular Cell, https://doi.org/10.1016/j.molcel.2014.05.015.
[3] Pisco & Huang, (2015). Non-genetic cancer cell plasticity and therapy-induced stemness in tumour relapse: ‘What does not kill me strengthens me’. BJC, https://doi.org/10.1038/bjc.2015.146
文章导航
4660 La Jolla Village Dr Tel:858-8637885 SDChinesePress@Gmail.COM
 两种不同的“逃脱方法”
两种不同的“逃脱方法”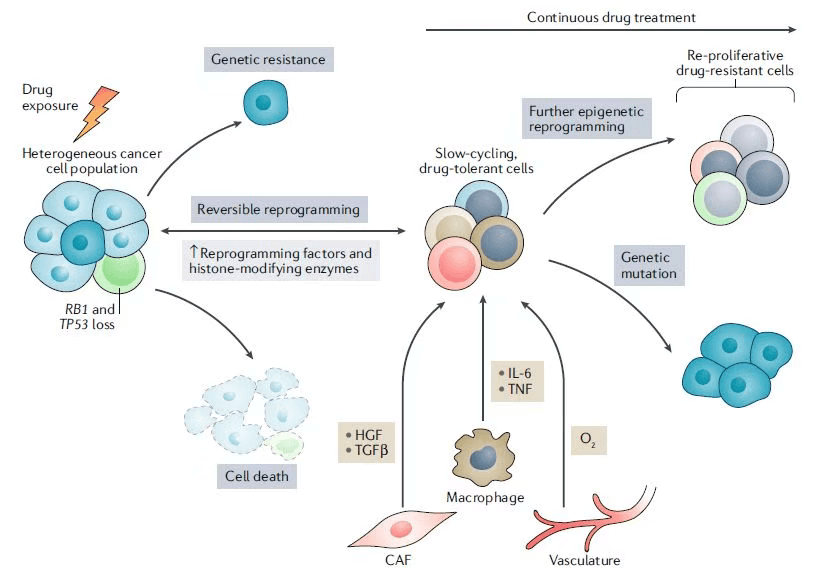 ▲基因突变介导和表观遗传学介导的耐药性(图片来源:参考资料[2])
▲基因突变介导和表观遗传学介导的耐药性(图片来源:参考资料[2]) ▲癌细胞产生暂时药物耐受和永久抗药性的重编程过程(图片来源:参考资料[1])
▲癌细胞产生暂时药物耐受和永久抗药性的重编程过程(图片来源:参考资料[1])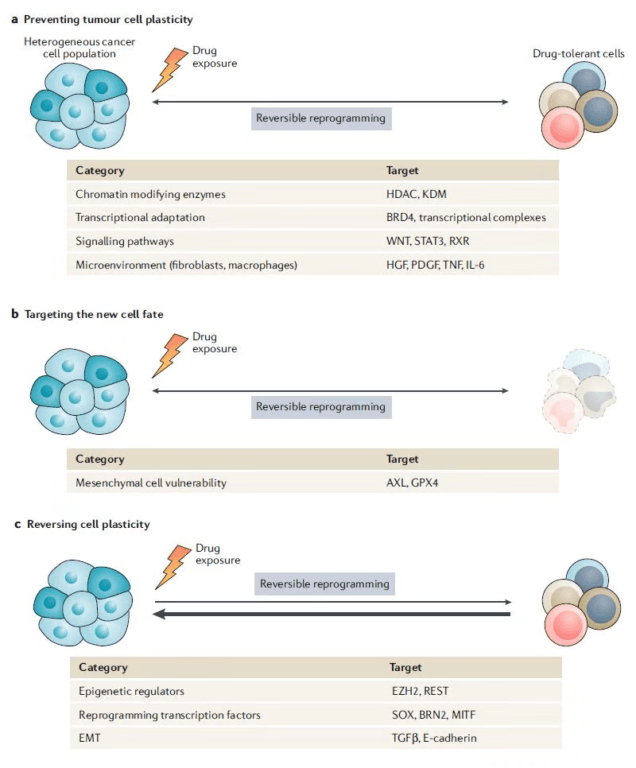 ▲针对细胞可塑性的三种治疗策略(图片来源:参考资料[1])
▲针对细胞可塑性的三种治疗策略(图片来源:参考资料[1])