药明康德第一时间报道:困扰男性数千年的“杀手”,如今有了一系列新突破!
在葡萄牙首都里斯本的国家考古博物馆里,存放着一具古埃及中年男性的木乃伊。前不久,科学家对这具尸体研究后发现,其骨盆和腰椎之间有许多高密度的圆形肿瘤,这是前列腺癌的典型表现。而且,他的前列腺癌已经扩散,遍及全身多处骨骼。
从古埃及到现在,2000多年过去了。如今,前列腺癌已经是男性最常见的癌症之一,每9名男性中,就有1人会在一生中罹患前列腺癌。不过据美国癌症协会的权威报告统计,与1993年相比,前列腺癌患者在2014年的死亡率锐减51%。这反映了前列腺癌诊疗在过去几十年里的巨大进步。在今天的这篇文章中,药明康德内容团队也将与各位读者一道,重温人类的前列腺癌对抗史。
从首例前列腺癌到两个诺奖
现在的人们很难想象,前列腺癌在1853年被首次确诊时,竟被认为是“一种非常罕见的疾病”。在接下来的近一个世纪里,科学家和医生们取得的进展也极为有限。上世纪40年代,前列腺癌是死亡的代名词,确诊后,患者的生存期仅有1-2年。
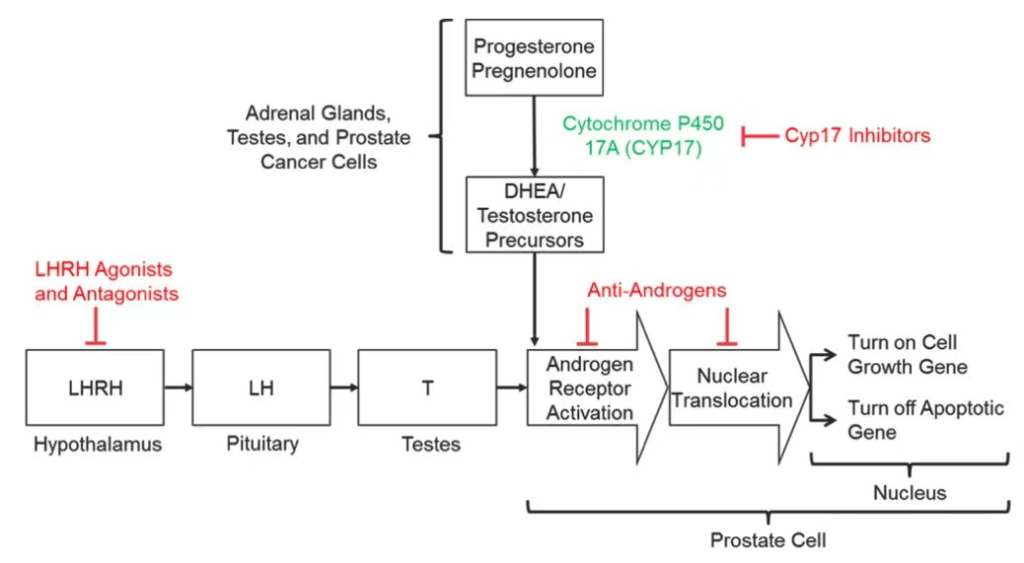
转机出现在1941年。这一年,美国芝加哥大学的查尔斯·哈金斯(Charles Huggins)教授与合作伙伴们发表了多篇论文,揭示了激素与前列腺之间的关系。理论上讲,前列腺的生长与发育依赖于雄激素的作用。因此前列腺癌可能也和雄激素有所关联。换而言之,如果能抑制雄激素的功能,或许就能抑制前列腺癌的生长。
 ▲查尔斯·哈金斯教授(图片来源:Nobel Foundation archive)
▲查尔斯·哈金斯教授(图片来源:Nobel Foundation archive)
而在哈金斯教授的这一系列研究中,科学家们确认了雄激素与雌激素会展开竞争,相互抑制。与他们先前所设想的一样,通过给患者注射雌激素,能够有效地延缓前列腺癌的病情进展。此外,他们还发现通过手术切除睾丸,也能取得类似的效果。因此,这种通过降低雄激素水平来治疗肿瘤的做法,也被称作是“去势治疗”。
不少科学家认为,这是人类首次通过使用某种化学物质来成功控制前列腺癌的病情。由于发现了这种激素疗法,哈金斯教授也斩获了1966年的诺贝尔生理学或医学奖。
哈金斯教授的重大发现揭开了前列腺癌内分泌疗法的帷幕。在此后几十年里,科学突破层出不穷,多种抑制雄激素的药物也相继出现。其中一个重要的推动来自于安德鲁·萨利(Andrew Schally)教授团队。他们的研究表明,一种叫黄体生成素释放激素(LHRH)的下丘脑激素,可以通过一系列生化通路,最终促进睾酮的生成,而睾酮正是一种主要的雄激素。基于这个发现,科学家们开发出了一种叫做LHRH类似物的药物。在患者体内,高水平的LHRH类似物能够抑制睾酮的生成,同样起到治疗效果。由于发现LHRH,萨利教授也与另外两名科学家一道,分享了1977年的诺贝尔生理学或医学奖。
 ▲安德鲁·萨利教授(图片来源:Nobelprize.org)
▲安德鲁·萨利教授(图片来源:Nobelprize.org)
激素疗法不断突破瓶颈
然而道高一尺,魔高一丈。随着时间推移,人们逐渐发现在去势治疗后,癌细胞会逐渐适应这种低激素水平的环境,继续生长。此时,疾病也进展成为了“去势抵抗性前列腺癌”(CRPC)。因为前列腺癌病程较长,这几乎是所有前列腺癌后期一个不可避免的阶段,患者的中位生存期也只有1到2年。
去势抵抗性前列腺癌的存在一度让抑制雄激素的内分泌疗法陷入瓶颈,治疗仅依赖于化疗和放疗等极其有限的手段。直到新世纪,相关治疗领域才终于又迎来了新的突破。
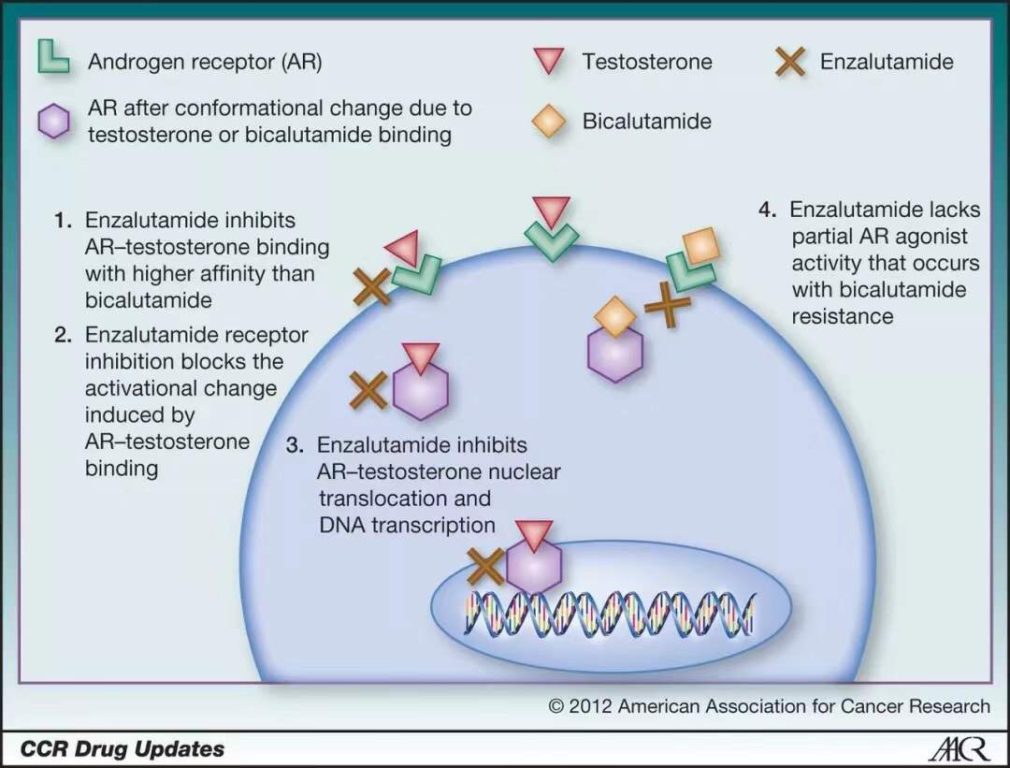
其中的突破之一是“抗雄激素疗法”。与先前的疗法不同,这类疗法直接作用于雄激素受体,抑制雄激素与其结合,做得更为彻底。事实上,早在1989年,第一代抗雄激素疗法flutamide就已获美国FDA批准上市。然而早期抗雄激素与雄激素受体的亲和力并不高,因此限制了这类疗法的应用。
2012年,由Medivation(后被辉瑞收购)与安斯泰来(Astellas)共同开发的Xtandi(enzalutamide)获批上市。作为新一代抗雄激素疗法,它既能抑制雄激素与其受体结合,还能抑制雄激素受体进入细胞核,阻止它启动下游的生化通路。在罹患去势抵抗性前列腺癌,且病情已发生转移,化疗都无能为力的患者中,倘若接受了Xtandi的治疗,有一半的患者能活过18.4个月。这一数字比安慰剂对照组多出了近5个月。
2018年和2019年,杨森(Janssen)的Erleada(apalutamide)与拜耳(Bayer)的Nubeqa(darolutamide)也先后获FDA批准上市,加入到了治疗去势抵抗性前列腺癌的大军中。
值得一提的是,就在今年9月,Erleada还获批治疗去势敏感性的前列腺癌,进一步扩大了能够造福的人群。在临床试验中,它显著延长了患者的总生存期,并将死亡风险减少了33%。而Xtandi在治疗激素敏感性前列腺癌的临床实验中,同样达到了延长总生存期的终点,有望在今年年底前获批。
目前,中国也已有3家药企的二代抗雄激素药进入3期临床试验,包括恒瑞医药的SHR3680、开拓药业的普克鲁胺和海思科的HC-1119。
 ▲抑制雄激素信号通路的药物机制(图片来源:参考资料[10])
▲抑制雄激素信号通路的药物机制(图片来源:参考资料[10])
在二代抗雄激素之外,还有2011年获FDA批准的Zytiga(abiraterone)这种新的激素疗法。它虽然也能抑制雄激素,但原理并非提供相对抗的激素,也不是直接对抗其受体。相反,它靶向的是雄激素合成途径中的一个关键酶CYP17。
作为一种高效、选择性、不可逆的CYP17酶抑制剂,Zytiga能够阻断睾丸、肾上腺组织、前列腺癌组织中雄激素的合成,最大程度地降低体内雄激素水平。在一项有1195名患者参与的大型3期临床试验中,它的疗效也得到了确认。
“武器库”扩容:治疗方法多元化
激素疗法虽然不断获得突破,但是始终依靠抑制雄激素受体信号通路来遏制癌细胞的增殖。然而癌细胞最终会通过各种方式对激素疗法产生抗性。因此,研究人员也在开发多种不基于雄激素信号通路的创新疗法,为抗击前列腺癌的武器库中添加多元化的武器。
其中一种创新疗法是全球首款“治疗型”的肿瘤疫苗Provenge(sipuleucel-T)。作为一种个体化疗法,它会从患者的血液中分离出树突状细胞(一种抗体呈递细胞),并和一种特殊的融合蛋白共同培养。这种融合蛋白分为两部分,一种是前列腺酸性磷酸酶(PAP),这也正是前列腺癌细胞上的主要抗原;另一种则是免疫信号因子,促进这些抗体呈递细胞变得成熟。随后,这些经过处理,能够有效识别前列腺癌抗原的细胞又会被输回患者体内,并激活免疫T细胞,让其找到并杀伤表达PAP的癌细胞。3期临床试验结果也确认,它能够显著提高患者的中位生存期。
令人欣喜的是,最近一项研究结果发现,这些被肿瘤疫苗所激活的免疫细胞还具有长期记忆力,有望发挥长期的治疗效果。
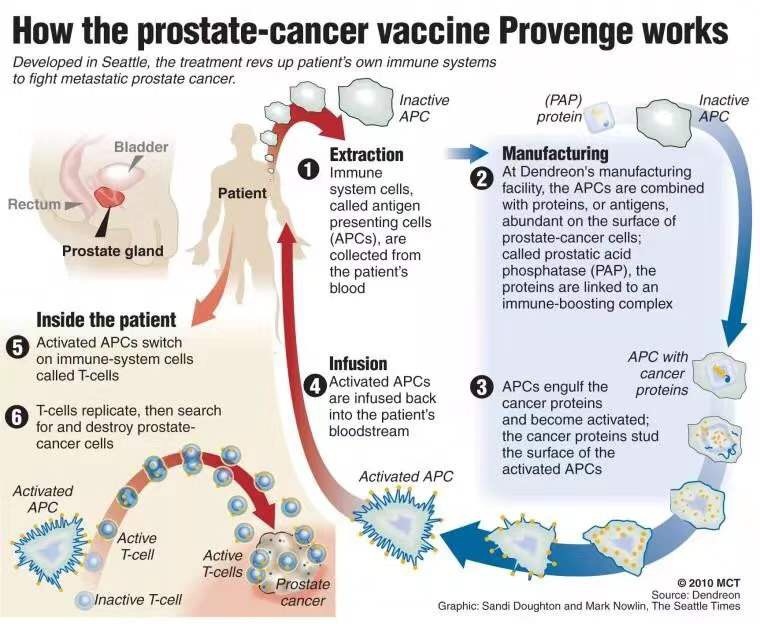 ▲肿瘤疫苗Provenge作用机理(图片来源:参考资料[11])
▲肿瘤疫苗Provenge作用机理(图片来源:参考资料[11])
除此之外,默沙东的明星免疫疗法Keytruda(pembrolizumab)也在早期的临床试验中取得了积极的结果,并已增加三项3期临床试验。将来,它也有望为前列腺癌患者带来福音。
除了上述的免疫疗法,根据癌症的分子特征而开发的靶向疗法也已成为癌症治疗的最新趋势。在前列腺癌方面,最新的突破来自PARP抑制剂的应用。例如,今年八月,默沙东(MSD)和阿斯利康(AstraZeneca)宣布,Lynparza(olaparib)在治疗转移性去势抵抗前列腺癌(mCRPC)男性患者的3 期临床试验中取得积极结果,这些患者携带同源重组修复基因突变 (HRRm) 且既往接受激素抗癌治疗(如enzalutamide和阿比特龙)后疾病进展。
未来的方向:预防与新疗法将构建强有力的防线
在前列腺癌疗法取得一系列突破的同时,前列腺癌的诊断也取得了重要的突破。目前,一种叫做前列腺特异抗原(PSA)的蛋白质已经过了几十年的验证,能用于前列腺癌的早期筛查、辅助诊断、治疗监测、以及指导预后。最近,《柳叶刀》一项长达13年的随访结果显示,在 55-69 岁男性中,PSA 筛查使前列腺癌死亡率下降了21%,而且与随访 9 年和11年的结果相比,这种获益呈增长趋势。这也印证了早期筛查对前列腺癌的重要性。
当前,虽然前列腺癌的发病率依旧高居不下,但这在一定程度上也反映了诊断筛查技术的进步。在一系列可用的疗法下,患者的疾病已能得到很好的控制与治疗。确诊前列腺癌,也不再等于会在短期内离开人世。
在这些进步面前,科学家们也没有停下研发的步伐,无论在患者早筛还是创新疗法开发方面都取得了积极进展。例如,近日Bio-Techne公司基于外泌体的液体活检测试获得美国FDA授予的突破性医疗器械认定。它可以让前列腺癌患者无需接受侵袭性组织活检,就可以判断前列腺癌的类型。
在创新疗法的开发方面,杨森公司近日宣布,PARP抑制剂尼拉帕利获得FDA的突破性疗法认定,治疗去势抵抗性前列腺癌患者。今年5月,药明康德合作伙伴Arvinas宣布其领先的PROTAC蛋白降解疗法ARV-110斩获美国FDA授予的快速通道资格。ARV-110可以直接降解雄激素受体,它可以对雄激素受体过度表达或产生突变的癌症患者产生疗效,从而造福那些对第二代激素疗法缺乏响应的mCRPC患者。目前这款疗法已经进入临床试验,初步数据有望在今年晚些时候公布。
随着早期筛查技术和创新疗法的不断涌现,人类能否早日消灭前列腺癌这个困扰男性数千年的杀手?让我们拭目以待吧!
参考资料:
[1]漫谈前列腺癌特异性抗原 ——一场穿越时空的印记 Mar 27, 2017, from https://dialog.roche.com/cn/zh_cn/news/all-news/public-cn-news20170328-3.html
[2]B.Tombal. Appropriate Castration with Luteinising Hormone Releasing Hormone (LHRH) Agonists: What is the Optimal Level of Testosterone? European Urology Supplements, 2005 (4): 14–19
[3]Mark A Perlmutter, MD and Herbert Lepor, MD. Androgen Deprivation Therapy in the Treatment of Advanced Prostate Cancer, Rev Urol. 2007; 9(Suppl 1): S3–S8.
[4]Samuel R. Denmeade, John T. Isaacs. A history of prostate cancer treatment,Nat Rev Cancer, 2002 May; 2(5): 389–396.
[5] 韩苏军,张思维,陈万青等.中国前列腺癌发病现状和流行趋势分析, 临床肿瘤杂志, 2013 Apr; 18(4): 330-334
[6]免疫疗法,只知PD-1?全球最新免疫疗法汇总——前列腺癌篇,Jul 18, 2019, from http://www.sohu.com/a/327681515_452785
[7] 喜讯!蛋白降解疗法获FDA快速通道资格,治疗前列腺癌May 30, 2019, from https://mp.weixin.qq.com/s/M56Mj-2IAifD4J7ACLIGMA
[8] PARP抑制剂奥拉帕利治疗前列腺癌达到3期临床主要终点 Aug 8,2019, from https://med.sina.com/article_detail_103_2_69707.html
[9] Hoffman-Censits and Kelly, (2013). Enzalutamide: A Novel Antiandrogen for Patients with Castrate-Resistant Prostate Cancer. Clinical Cancer Research, DOI: 10.1158/1078-0432.CCR-12-2910
[10] Crawford et al., (2018). Androgen-targeted therapy in menwith prostate cancer: evolving practice and future considerations. ProstateCancer and Prostatic Diseases. https://doi.org/10.1038/s41391-018-0079-0
[11] FDA approves country’s first cancer treatment vaccine.Retrieved October 12, 2019, from https://www.newsrecord.org/fda-approves-country-s-first-cancer-treatment-vaccine/article_aa95ab61-c05f-537c-ac3f-1e07bce241c0.html