吉利德科学公司的实验药物“Remdesivir”被视为最有希望的冠状病毒潜在治疗药物之一,日前从美国食品和药物管理局获得了孤儿药( orphan drug )的称号。
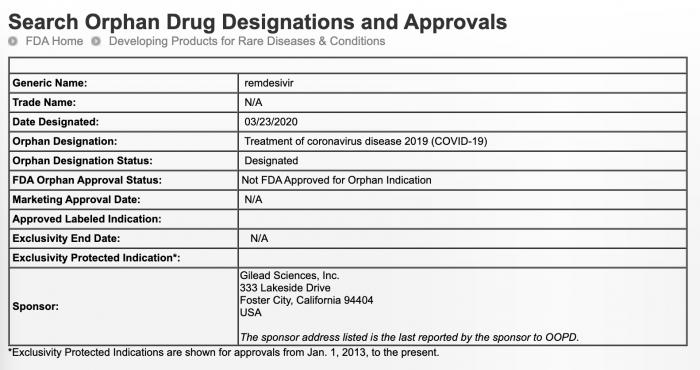
美东时间3月23日,美国食药监总局FDA网站出了一项关于瑞德西韦(remdesivir)新批示:
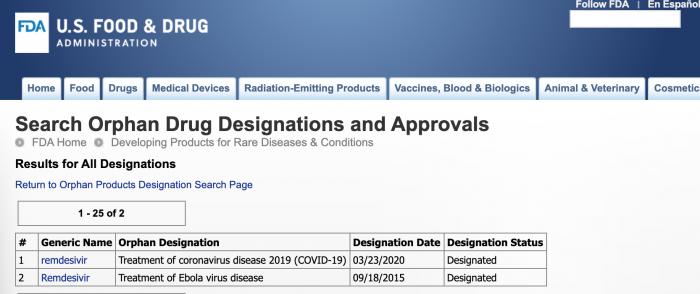
这项认定相当于FDA给瑞德西韦的新冠肺炎(COVID-19)适应症安了一个头衔,注意不是上市获批,瑞德西韦目前还在全球各地做临床试验。
且这个头衔其实在之前针对埃博拉病毒的适应症中也有,2015年9月就拿到了:
有了这个头衔有什么用呢?
这跟FDA对罕见病药物也就是“孤儿药”的优惠政策有关。近两年FDA批准上市的新药中,罕见病药物占了很大的比例。特别是在前任FDA局长Scott Gottlieb的任上,有了很大的推动。
2020年1月6日,FDA下属药物评估和研究中心(CDER)发布了一年一度的新药批准报告,2019年CDER批准了批准了48种新药,其中有21种(占44%)被批准用于治疗罕见疾病,与肿瘤药物“分庭抗礼”。2018年FDA批准的59种新药中有34种(58%)被批准用于治疗罕见病的药物,影响人数在20万或更少的“孤儿”疾病上,创下了历史记录。
2019年,CDER列出了多种罕见病药物的获批,包括囊性纤维化(CF);Scenesse(afamelanotide)植入物可增加因红血球性原卟啉症而引起的光毒性反应(对日光敏感)患者的无痛暴露,这是一种罕见的病症,由通常会帮助红细胞向身体输送氧气的化学物质过多积聚造成的,即使短暂的日晒也可能导致皮肤疼痛;Turalio(pexidartinib)胶囊,适用于某些患有腱鞘巨细胞瘤的成年患者,这种罕见病涉及关节区域周围的非癌性肿瘤。其余还包括首例治疗视神经脊髓炎频谱疾病的方法,治疗镰状细胞病患者的新药,以及一种可以减缓系统性硬化症相关性间质性肺病患者的肺功能下降速度(SSc-ILD)的新型疗法。
在这些拗口的疾病和药物名称背后,是研发、监管和商业公司对于小众疾病人群愈发重视的变化过程。
罕见病在各国的定义不同,在美国指影响少数人、特别是在美国不到20万人的疾病。但“罕见”病一词可能具有欺骗性。实际上,大约有7000种不同的罕见疾病,共同影响着多达3000万人,约占美国人口的10%。因此,尽管患有任何一种罕见疾病的患者人数可能很少,但对公共健康的累积影响却很大。
从医药工业上看,为大型患者群体开发药物以收回其临床开发投资并在财务上可行更具吸引力。但为了鼓励孤儿药的开发,美国出台了一系列法规,在1983年颁布了《孤儿药法案》,并在2013年6月12日,发布了修订最新的修订版本。2017年6月,又公布了新的孤儿药物现代化计划。
什么叫“孤儿药”
国会通过了《孤儿药法案》以刺激“孤儿药”的开发,“孤儿药”这个词源于药品开发行业行将遗忘或使其成为“孤儿”的罕见疾病药物。该法案为孤儿药开发引入了经济激励措施,包括对获批的孤儿药产品实行7年市场独占性,免除处方药使用费以及其他税收优惠。
FDA也成立了孤儿产品开发办公室(OOPD),其任务是推动对产品(药品,生物制品,设备或医疗食品)的评估和开发。OOPD也鼓励药企们开发罕见病产品。自1983年以来,该计划已成功地促进了600多种罕见病药物和生物产品的开发和营销。
《孤儿药法案》(ODA)规定,应保荐人的要求,给予药品或生物产品特殊的地位,以治疗罕见疾病或病症。此状态称为“孤儿药身份”,即为上述的认定。要使一种药物具有孤儿资格,该药物以及疾病或病症都必须符合ODA和FDA实施法规21 CFR 316部分规定的某些标准。
孤儿药的资格使药物的赞助者(即开发者,如药企)有资格获得ODA的各种发展激励措施,包括合格临床试验的税收抵免,已收到孤儿药证的处方药产品的营销申请书不需缴纳处方药使用者费用,除非该申请书中包括针对罕见病或指定药物的其他适应症。
当一家公司提交其指定为孤药的请求时,FDA的孤儿产品开发办公室将确定该产品是否符合孤儿药物的标准̶即疾病患病人数低于200,000,并且有医学上合理的预期依据该药物对罕见病有效。但FDA罕见疾病副主任Jonathan Goldsmith特别指出,“授予孤儿药的认定不会改变FDA的批准要求。孤儿药仍必须通过充分且受到良好控制的研究证明其安全性和有效性。”
同样的,瑞德西韦即便要以孤儿药的身份上市,还是需要严格的临床试验流程。
2月26日,吉利德科学官方宣布启动两项三期临床研究,以评估瑞德西韦在治疗新型冠状病毒肺炎成人患者中的安全性和有效性。
瑞德西韦是一种在研的核苷酸类似物,具有广谱抗病毒活性,在体外和体内动物模型中显示了对多种新兴病毒病原体的活性,包括埃博拉病毒、马尔堡病毒、中东呼吸综合征(MERS)和非典型性肺炎(SARS)病毒。针对瑞德西韦的研究曾在健康志愿者和埃博拉病毒感染者中展开。个别同情用药病例不足以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性,这只能通过未来的临床试验来确定。
瑞德西韦尚未在全球任何国家获得许可或批准,其安全性和有效性尚未被证实。
吉列德科学病毒学副总裁Tomas Cihlar此前表示,关于瑞德西韦“过去几周我们已开始在中国开展两项临床试验,分别针对两种处在不同疾病发展状态的新冠肺炎患者。
此前在国内开展的瑞德西韦临床并不是由吉利德发起,而是由研究者所发起。本来并不是吉利德申请药物上市的数据,但Tomas Cihlar强调,“这两项研究均为双盲,含安慰剂对照的临床试验,在设计上它们可以成为3期临床试验。这意味着如果能在其中一项或者两项研究中看到瑞德西韦的疗效,这些数据有可能成为支持新药上市的注册性数据。我们也将在适当的时候决定是否开展独立的药物安全性检测,以及进行初步和中期临床试验数据分析。这可以帮助我们尽早了解安慰剂和治疗组患者的表现,以便早日确定该药物的疗效和安全性参数,以及如何在这一疫情中使用它。”
而其他药企是否能仿制瑞德西韦,也要看吉利德在该地区为其申请的专利情况以及后续授权行为。此前武汉病毒所也针对瑞德西韦申请了用途专利,但该用途专利是否能够授权,还是得看实质审查其三性(新颖性、实用性和创造性)等要求,用途专利本身的授权不需要吉利德的授权。但是在生产、使用时,使用的是药品本身,则需要得到吉利德的授权许可。通常情况下,被许可人需要与吉利德签订专利许可合同。
吉列德自己也为Remdesivir在全球各地申请了相关一系列的专利,从化合物结构到药品用途等。21世纪经济报道查阅国家知识产权局网站公布公告显示,2016年9月16日吉利德申请了一项“治疗沙粒病毒科和冠状病毒科病毒感染的方法”的发明专利,申请公布号为CN108348526A,“提供了通过施用式I的核苷及其前药来治疗沙粒病毒科和冠状病毒科病毒感染的方法,其中核苷糖的1’位被取代。所提供的化合物、组合物和方法对于治疗拉沙病毒和胡宁病毒感染特别有用。”并公布了相关化学式,这个用途专利概括了冠状病毒的范围。
在2月风口浪尖之时,吉利德官方曾回应了关于瑞德西韦的专利问题。吉利德科学的全球CEO Daniel O’Day表示,“专利并不是眼下我们首要关心的问题。我问过负责专利的同事,就像吉利德的其他药物一样,我们已经为Remdesivir在全球各个地区申请了化合物、使用专利包括冠状病毒。我们不会卷入这个专利的问题,我们会找到方法来帮助患者,当然我们也会以另外的办法保护我们的知识产权,但是患者是第一位的。”
“目前,吉利德并没有考虑这种在研药物的潜在商业价值。我们现在关注的是瑞德西韦可能为患者带来的潜在临床价值,并尽我们的所能帮助应对新冠病毒肺炎的暴发。吉利德也在与监管机构进行讨论,以确定在临床试验结果积极的情况下,瑞德西韦可以获得批准的最恰当的路径。”
Remdesivir 目前是被认为治疗冠状病毒最有潜力的药物之一。是美国吉利德公司正在研发中的一种试验性的抗病毒药物,未获批上市,先前曾用于抗埃博拉病毒感染的临床试验,且在体外及动物研究中对严重急性呼吸综合征(SARS)冠状病毒和中东呼吸综合征(MERS)冠状病毒等显示较好的抗病毒活性。其“孤儿药”的资质为制药公司提供了7年的市场独占期,以及税收和其他激励措施,以开发治疗影响近20万人罕见疾病的方法。
吉拉德日前表示,由于对这种药物的所谓同情性使用请求呈指数级增长,暂时搁置对Remdesivir的新的紧急使用。
另外,美国官方称目前还没有针对确认的冠状病毒(COVID-19)治疗或预防性疫苗。大多数病人目前只接受支持性护理,如呼吸辅助等。
题图为位于加州佛斯特市的吉利得公司。
(美国华文网 圣地亚哥华文网编发 USChinesePress.com SanDiegoChinesePress.com)