加州大学圣地亚哥分校(UCSD)的研究人员首次使用CRISPR/CAS9控制小鼠的遗传。该研发技术为啮齿类动物的人类疾病研究提供了强有力的新基因工具。
加州大学圣地亚哥分校的生物学家开发了世界上第一种基于CRISPR/CAS9的方法来控制哺乳动物的遗传。
 主要开发人员:加州大学圣地亚哥分校研究生Hannah Grunwald和助理教授Kimberly Cooper。
主要开发人员:加州大学圣地亚哥分校研究生Hannah Grunwald和助理教授Kimberly Cooper。
世界各地的科学家一直在利用CRISPR/CAS9编辑各种动植物物种的遗传信息。编辑基因组的一种方法可以控制将一个基因的两个拷贝中的哪一个传递给下一代。尽管近几年来在昆虫身上已经发展出这种“主动遗传学”方法,但在哺乳动物身上创造这种工具更具挑战性,而且由于世代之间的时间更长,因此测试它们需要更长的时间。
加州大学圣地亚哥分校该研发小组于1月23日在《自然》杂志上发表了他们的研究成果,他们在老鼠身上开发了一种新的主动基因技术。加州大学圣地亚哥分校研究生Hannah Grunwald、助理研究员Valentino Gantz以及Kimberly Cooper助理教授领导的同事们的成就为基于这一技术的进一步发展奠定了基础,包括对人类疾病的生物医学研究。
Cooper说:“我们的动机是将其开发成实验室研究人员控制小鼠多基因遗传的工具。”“随着进一步的发展,我们认为将有可能使复杂的人类遗传疾病的动物模型,如关节炎和癌症,这是目前不可能的。”
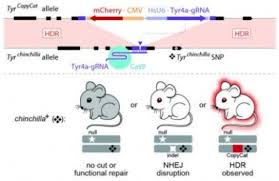
为了证明在小鼠身上的可行性,研究人员将一种活跃的基因“模仿”DNA元素设计成控制毛发颜色的酪氨酸酶基因。当copycat元素破坏老鼠基因的两个拷贝时,原本应该是黑色的毛发就变成了白色,这显然是他们方法成功的证明。模仿元素的设计也使得它不能独自在种群中传播,而昆虫的crispr/cas9“基因驱动”系统则建立在一个相似的潜在分子机制之上。
在为期两年的项目期间,研究人员使用各种策略来确定复制的元素可以从一个染色体复制到另一个染色体,以修复crispr/cas9所针对的DNA断裂。结果,最初只出现在两条染色体中的一条上的元素被复制到另一条染色体上。在其中一个家庭中,多达86%的后代继承了来自女性父母的模仿元素,而不是通常的50%。
题图为小鼠模仿图。
这种新方法在雌鼠产卵期间有效,但在雄鼠精子生产期间无效。这可能是由于男性和女性减数分裂的时间不同,这是一个正常配对染色体以洗牌基因组的过程,可能有助于这种工程复制事件。
据加州大学圣地亚哥分校教授伊桑·比尔(Ethan Bier)的研究合著者称,研究结果“为合成生物学的各种应用开辟了道路,包括研究不同生物过程的复杂遗传系统的模块化组装。”
库珀和她实验室的成员们现在开始基于一个单一基因的哺乳动物主动遗传成功,并试图将该工具扩展到多个基因和特性。
“我们已经证明,我们可以将一个基因型从杂合子转换为纯合子。现在我们想看看我们是否能有效地控制动物三个基因的遗传。库珀说:“如果这种方法能同时应用于多种基因,它将彻底改变小鼠的遗传学。”
虽然这项新技术是为实验室研究开发的,但有些人已经预见到未来的基因驱动将在野外建立在这种方法的基础上,以努力恢复包括啮齿动物在内的入侵物种所破坏的生态系统中自然生物多样性的平衡。
Bier说:“通过进一步的改进,应该有可能开发基因驱动技术,以改变或可能减少作为疾病载体或对本土物种造成损害的哺乳动物种群。”
这些数据还表明,在野外实际使用所需的技术改进,使人们有时间仔细考虑这种新技术的哪些应用可以和应该得到实施。然而,研究人员注意到,他们的研究结果显示出了巨大的进步,可能已经减少了推进人类疾病生物医学研究和了解其他类型复杂遗传特征所需的时间、成本和动物数量。
Cooper说:“我们也有兴趣了解进化的机制。对于某些已经进化超过10英里的特性。“
(美国华文网 圣地亚哥华文网 华文风采编发 USChinesePress.com SanDiegoChinesePress.com)